Theo Tổ chức Y tế Thế giới (WHO), năm 2012, thế giới có 782.000 ca ung thư gan mới được phát hiện, trong đó 83% gặp ở các nước kém phát triển, riêng ở Trung Quốc là 50%. Ung thư biểu mô tế bào gan (hepatocellular carcinoma: HCC) là nguyên nhân dẫn đến 1/3 số ca tử vong do ung thư.
06/12/2017 | PGS TS Nguyễn Nghiêm Luật – một người thầy bình dị
Nguyên nhân dẫn đến HCC gồm: viêm gan virus B, viêm gan virus C, xơ gan, nghiện rượu, béo phì, đái tháo đường, quá tải sắt, nhiễm độc aflatoxin,… Việc phát hiện HCC ở giai đoạn sớm rất quan trọng bởi vì việc điều trị HCC bằng phẫu thuật, ghép gan hoặc cắt bỏ khối u chỉ hiệu quả ở giai đoạn sớm của bệnh. Trước đây, chiến lược sàng lọc nhằm phát hiện sớm HCC được đề nghị gồm việc đo mức độ α-fetoprotein (AFP) huyết thanh và siêu âm ổ bụng 3-6 tháng một lần. Tuy nhiên, mức độ AFP huyết thanh có tỷ lệ (-) tính giả cao khi khối u còn nhỏ (giai đoạn sớm) và tỷ lệ (+) tính giả cũng cao vì mức độ AFP cũng có thể tăng ở bệnh nhân xơ gan hoặc viêm gan mạn. Chính vì vậy, việc tìm ra những dấu ấn khối u mới có độ nhạy, độ đặc hiệu, giá trị dự đoán (+) tính, giá trị dự đoán (-) tính và độ chính xác cao hơn là điều rất quan trọng. Gần đây, một số dấu ấn khối u của HCC mới được bổ sung gồm dạng gắn lectin của AFP là AFP-L3 và DCP (Des-γ-carboxyprothrombin), còn gọi là PIVKA-II (prothrombin induced by vitamin K absence-II). Trong bài này, giá trị của sự kết hợp các dấu ấn khối u AFP, AFP-L3 và DCP trong phát hiện sớm, chẩn đoán phân biệt, theo dõi hiệu quả điều trị, tái phát và tiên lượng HCC sẽ được phân tích.
1. Đại cương về AFP, AFP-L3, DCP, GALAD và BALAD
1.1. AFP: AFP là một glycoprotein lớn có trong huyết thanh, gồm 591 gốc acid amin. Trong điều kiện sinh lý, AFP là một glycoprotein đặc hiệu cho thai, có khối lượng phân tử 70 kDa. Nó được tổng hợp chủ yếu bởi gan của bào thai, bởi các tế bào của túi noãn hoàng và bởi ồng tiêu hóa của thai trong quý 1 của thai kỳ, có thời gian bán hủy (half-life) là 5-7 ngày. Mức độ AFP huyết thanh giảm nhanh sau khi sinh và khi trưởng thành chỉ còn < 10 ng/mL. AFP có thể tăng trong HCC, ung thư biểu mô bào thai, ung thư dạ dày hoặc phổi, nhưng cũng có thể tăng trong viêm gan mạn hoặc xơ gan. Nhiều nghiên cứu đã chỉ ra rằng độ nhạy chẩn đoán HCC của AFP chỉ đạt 39-45% và độ đặc hiệu là 76-94%.
1.2. AFP-L3: AFP có 3 dạng khác nhau, tùy thuộc vào khả năng gắn chuỗi carbohydrate, là AFP-L1, AFP-L2 và AFP-L3. AFP-L1 có trong viêm gan mạn, xơ gan và là thành phần chính của AFP toàn phần trong những bệnh gan lành tính. AFP-L2 có nguồn gốc chủ yếu từ các khối u túi noãn hoàng (yolk sac tumors). AFP-L3 là dạng chủ yếu của AFP huyết thanh bệnh nhân HCC, có thể được phát hiện bởi Lectin CLA (Lens culinaris agglutinin), là chất có ái lực đối với gốc Fucose (Hình 1).

Hình 1. Cấu trúc chuỗi carbohydrate của AFP-L1 và AFP-L3.
Giá trị AFP-L3 ở người khỏe mạnh là < 10%. Ở giá trị cắt (cut-off) của AFP-L3 là 10-15%, có thể được phát hiện khoảng 1/3 số bệnh nhân có khối u HCC nhó < 3 cm. Khi sử dụng giá trị cắt của AFP-L3 là 15%, độ nhạy và độ đặc hiệu để chẩn đoán HCC tương ứng là 75-96,90% và 90-92%.
1.3. DCP (Des-γ-carboxy prothrombin): DCP là một sản phẩm bất thường của prothrombin do rối loạn sự carboxyl hóa của gan trong quá trình tạo thành thrombogen và tác động như một yếu tố tự phân bào (autologous mitogen) đối với dòng tế bào HCC. Bình thường, tiền chất prothrombin phải trải qua sự carboxyl hóa phụ thuộc vitamin K của 10 gốc glutamic acid ở đầu tận N của chuỗi polypeptide để sản xuất ra phân tử prothrombin tự nhiên. Trong HCC, sự chuyển dạng này bị cản trở do enzyme carboxylase bị ức chế, dẫn đến sự tích lũy của DCP (Hình 2). Thời gian bán hủy của DCP trong huyết thanh là 4 ngày. Giá trị DCP huyết thanh ở người khỏe mạnh là < 7,5 ng/mL.
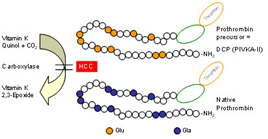
Hình 2. Trong HCC, sự chuyển dạng từ DCP thành prothrombin bị cản trở, DCP tích lũy và tăng lên trong huyết thanh.
Bộ ba các dấu ấn khối u AFP, AFP-L3 và DCP huyết thanh được đo bằng kỹ thuật định lượng điện di mao quản vi mạch và pha lỏng trên máy phân tích tự động μTAS Wako i30 (Wako Pure Chemical Industries, Ltd, Osaka, Nhật Bản). Phạm vi đo là 0,3-1000 ng/ mL đối với AFP và 5-50 000 AU/ L đối với DCP. Mức AFP-L3 được đo trong huyết thanh với nồng độ AFP là trên 0,3 ng/mL.1.4. GALAD: GALAD là một mô hình toán thống kê được sử dụng để đánh giá sự có mặt của HCC. GALAD được tính toán dựa trên 5 thông số, gồm ba dấu ấn khối u AFP, AFP-L3 và DCP cộng thêm với giới tính (Gender) và tuổi (Age), sử dụng phương trình sau: Z = -10,08 + 0,09 × Tuổi + 1,67 × Giới tính + 2,34 log10 (AFP) + 0,04 × AFP-L3 + 1,33 × log10 (DCP), Ở đây giới tính nam = 1 và giới tính nữ = 0. Lấy số mũ (exponential) của yếu tố dự báo tuyến tính (Z), dự đoán HCC Pr(HCC) ở bệnh nhân (xếp từ 0 đến 1) được đánh giá bằng phương trình: Pr(HCC) = exp (Z)/ (1 + exp [Z]).1.5. BALAD: BALAD là một mô hình toán thống kê được sử dụng để đánh giá thời gian sống sót (tính bằng tháng) của bệnh nhân HCC. BALAD được tính toán dựa trên 5 thông số, gồm ba dấu ấn khối u AFP, AFP-L3 và DCP cộng thêm với 2 dấu ấn của chức năng gan là Bilirubin và Albumin huyết thanh, sử dụng phương trình: Yếu tố dự đoán tuyến tính = (0,02 × ([AFP] – 2,57) + 0,012 × ([AFP-L3] – 14,19) + 0,19 × (ln[DCP] – 1,93) + 0,17 × ([BIL]1/2 – 4,50) – 0,09 × ([ALB] – 35,11), Ở đây, AFP và DCP được tính theo ng/mL, Bilirrubin theo µmol/L và Albumin theo g/L. Ở Việt Nam, nghiên cứu trên 46 người khỏe mạnh (28 nữ và 18 nam), Mai MT và cs 2016 [7] thấy rằng giá trị của AFP, AFP-L3 và DCP không có sự khác nhau giữa nam và nữ (Bảng 1).
Bảng 1. Mức độ AFP, AFP-L3 và DCP ở người bình thường Việt Nam (Khoa MT, 2016 [7]).
Giới
n
AFP (ng/mL)
AFP-L3 (%)
DCP (mAU/mL)
Nam
18
1,6 ± 0,86
< 0,5
18,16 ± 6,26
Nữ
28
1,0 ± 1,14
< 0,5
17,32 ± 4,71
Khoảng
46
0,6 – 5,5
1,9 – 34
Có sự giảm nhẹ DCP ở nhóm người trên 40 tuổi (Bảng 2).
Bảng 2. Mức độ AFP, AFP-L3 và DCP ở người Việt Nam theo độ tuổi (Khoa MT, 2016 [7]).
Độ tuổi
n
AFP (ng/mL)
AFP-L3 (%)
DCP (mAU/mL)
< 40
34
1,3 ± 2,04
< 0,5
18,3 ± 8,62
>40
12
1,5 ± 0,67
< 0,5
15,4 ± 3,46
2. Vai trò của AFP, AFP-L3, DCP, GALAD và BALAD trong chẩn đoán HCC
2.1. Vai trò của sự kết hợp AFP, AFP-L3, DCP và GALAD trong phát hiện sớm HCC Trong một nghiên cứu trên 96 bệnh nhân, Yamamoto K, et al, 2010 [14] thấy rằng có sự khác nhau một cách có ý nghĩa về AFP (P<0,05) và DCP (P<0,0001), trong khi AFP-L3 không thay đổi một cách có ý nghĩa khi kích thước khối u tăng và khi có xâm lấn mạch máu. Chỉ có DCP tăng khi khối u biệt hóa kém (P<0,05) (Bảng 3).
Bảng 3. Sự liên quan giữa các đặc điểm của khối u HCC và các dấu ấn khối u AFP, AFP-L3 và DCP ở 96 bệnh nhân (Yamamoto K, 2010 [14]).
Các đặc điểm của HCC
n (%)
AFP (ng/mL)
AFP-L3 (%)
DCP (AU/L)
Kích thước khối u (cm)
≤ 2
2-5
>5
33 (34,4)
39 (40,6)
24 (25)
5,0 (3,0-32,0)
7,0 (4,0-384,0)
17,5 (5,3-811,3)
rs=0,25, P<0,05
0,0 (0,0-1,0)
0,0 (0,0-9,4)
0,5 (0,0-14,0)
rs=0,14, P=0,17
20,0 (16,0-29,0)
74,0 (22,0-203,0)
924,0 (220,5-10286,0)
rs=0,66, P<0,0001
Số lượng khối u
1
2
≥3
64 (66,7)
23 (24,0)
9 (9,3)
7,5 (4,0-142,8)
10,0 (4,0-126,0)
37,0 (3,0-1998,0)
P=0,88
0,0 (0,0-2,3)
0,3 (0,0-9,4)
0,5 (0,0-7,5)
P=0,76
70,0 (19,0-414,8)
36,0 (23,0-288,0)
164,0 (17,0-459,0)
P=0,93
Sự xâm lấn mạch máu
Không
Có
58 (60,4)
38 (39,6)
6,0 (3,0-53,5)
17,5 (5,0-795,8)
P<0,05
0,0 (0,0-3,5)
0,5 (0,0-10,4)
P=0,70
31,5 (18,5-224,3)
132,5 (27,3-789,8)
P < 0,05
Sự di căn trong gan
Không
có
84 (87,5)
12 (12,5)
7,5 (4,0-119,5)
78,5 (4,0-687,0)
P=0,38
0,0 (0,0-6,1)
0,3 (0,0-3,2)
P=0,92
45,5 (20,0-200,5)
377,0 (58,3-12143,0)
P=0,06
Sự biệt hóa của khối u
Tốt
Trung bình
Kém
11 (11,5)
70 (72,9)
15 (15,6)
4,0 (2,0-14,0)
7,0 (4,0-143,5)
34,0 (7,0-1072,0)
P=0,10
0,0 (0,0-0,5)
0,0 (0,0-5,3)
0,5 (0,0-21,8)
P=0,10
22,0 (16,0-108,0)
67,5 (19,8-312,0)
173,0 (32,0-9888,0)
P<0,05
Độ nhạy và độ đặc hiệu của các dấu ấn khối u đối với HCC có sự khác nhau khi các điểm cắt khác nhau được sử dụng (Bảng 4).
Bảng 4. Độ nhạy và độ đặc hiệu của các dấu ấn khối u đối với HCC ở các điểm cắt khác nhau (Yamamoto K, et al, 2010 [14]).
AFP (ng/mL)
Độ nhạy (%)
Độ đặc hiệu (%)
15
39,6
83,1
20
39,0
87,0
124
28,1
96,1
200
21,9
97,4
AFP-L3 (%)
Độ nhạy (%)
Độ đặc hiệu (%)
5
24,0
92,2
10
21,9
96,1
15
16,7
97,4
20
14,6
97,4
DCP (AU/L)
Độ nhạy (%)
Độ đặc hiệu (%)
20
77,1
58,4
30
59,4
80,5
40
55,2
90,9
60
52,1
96,1
Sự kết hợp AFP (ng/mL) và AFP-L3 (%)
Độ nhạy (%)
Độ đặc hiệu (%)
39,6
87
26,0
96,1
26,0
97,4
17,7
98,7
Sự kết hợp AFP (ng/mL) và DCP (AU/L)
Độ nhạy (%)
Độ đặc hiệu (%)
AFP 20, DCP 40
68,8
79,2
AFP 20, PIVKA-II 60
67,7
83,1
AFP 400, DCP 40
59,4
89,6
AFP 400, DCP60
57,3
94,8
Trong một nghiên cứu khác trên 168 bệnh nhân HCC, Choi JY et al, 2013 [3] thấy rằng AFP, AFP-L3 và DCP hoặc sự kết hợp các dấu ấn khối u này ở các mức độ AFP 10 ng/mL, 20 ng/mL và 200 ng/mL có độ nhạy và độ đặc hiệu khác nhau (Bảng 5). Sự kết hợp của AFP-L3 và DCP làm tăng độ nhạy và độ đặc hiệu tương ứng là 92,1% và 79,7%.
Bảng 5. Giá trị của AFP, AFP-L3 và DCP trong việc phát hiện HCC ở tất cả bệnh nhân và ở các mức độ AFP 10 ng/mL, 20 ng/mL và 200 ng/mL (Choi JY et al, 2013 [3]).
Sự kết hợp các dấu ấn khối u này có khả năng phát hiện sớm 81,8% HCC ở giai đoạn sớm (giai đoạn I), 86,7% khối u có kích thước nhỏ (<2 cm) và 91,7% một khối u đơn lẻ của HCC khi AFP thấp < 20 ng/mL (Bảng 6).
Bảng 6. Độ nhạy của AFP-L3 và DCP theo đặc điểm khối u ở bệnh nhân HCC có mức độ AFP <20 ng / mL (Choi JY et al, 2013 [3]).
Như vậy, sự xác định kết hợp AFP-L3 và DCP có giá trị trong việc phát hiện sớm HCC ở cả khi bệnh nhân có mức độ AFP tăng hoặc không tăng.Khi sử dụng GALAD, một thông số được tính toán dựa trên 5 thông số, gồm ba dấu ấn khối u AFP, AFP-L3 và DCP cộng thêm với giới tính (Gender) và tuổi (Age), các nghiên cứu ở Anh Quốc, Nhật, Đức đều cho thấy giá trị đường cong ROC của GALAD cao hơn một cách có ý nghĩa so với của các dấu ấn AFP, AFP-L3 và DCP trong HCC nói chung (Hình 3, biểu đồ A, B, C), và trong HCC giai đoạn sớm ở Anh Quốc và Nhật (biểu đồ D và E) (Berhane S và cs, 2016 [1]).
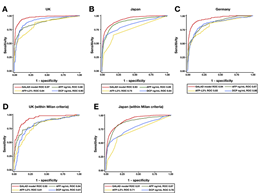
Hình 3. So sánh đường cong ROC của AFP (màu xanh lá cây), AFP-L3 (màu vàng), DCP (màu xanh lam) và GALAD (màu đỏ) trong chẩn đoán HCC từ các nghiên cứu ở Anh Quốc, Nhật và Đức (biểu đồ A, B, C) và cả trong chẩn đoán ở giai đoạn sớm ở Anh Quốc và ở Nhật (biểu đồ D và E) (Berhane S và cs, 2016 [1]). Cũng theo Berhane S và cs, 2016 [1], độ nhạy và AUROC của GALAD model và các dấu ấn khối u khác của HCC có sự khác nhau trong các nghiên cứu ở Anh Quốc và Nhật Bản (Bảng 7).
Bảng 7. So sánh giữa độ nhạy, độ đặc hiệu và diện tích dưới đường cong (AUROC) của GALAD model và các dấu ấn khối u khác của HCC (Berhane S và cs, 2016 [1]).
Model/ Dấu ấn khối u
Giá trị cắt
(Cut-off value)
Chẩn đoán sớm HCC (Tiêu chuẩn Milan)
AUC (95% CI)
P (GALAD so với các dấu ấn HCC khác)
Độ nhạy %
Độ đặc hiệu %
Phân loại chính xác %
Anh Quốc
GALAD
AFP
AFP-L3
DCP
AFP+AFP-L3+DCP
-0,63
20ng/mL
7%
0,48ng/mL
Các giá trị tương ứng
0,93 (0,90-0,96)
0,84 (0,79-0,89)
0,81 (0,76-0,85)
0,81 (0,77-0,86)
0,75 (0,72-0,77)
–
< 0,0001
< 0,0001
< 0,0001
< 0,0001
80,2
49,1
71,7
86,8
99,1
89,7
96,4
73,5
63,7
50,0
87,9
86,9
73,2
68,2
59,6
Nhật Bản
GALAD
AFP
AFP-L3
AFP+AFP-L3+DCP
-1,95
20ng/mL
7%
0,48ng/mL
Các giá trị tương ứng
0,91 (0,90-0,92)
0,87 (0,86-0,89)
0,71 (0,70-0,73)
0,78 (0,76-0,80)
0,80 (0,78-0,81)
–
< 0,0001
< 0,0001
< 0,0001
< 0,0001
82,1
42,2
30,3
41,4
71,2
81,6
97,3
91,8
97,4
88,3
81,7
84,6
77,5
84,5
84,3
Trong một nghiên cứu khác, Caviglia et al, 2016 [2] cho thấy GALAD có độ chính xác cao hơn AFP, AFP-L3, DCP hoặc sự kết hợp AFP-AFP-L3, DCP trong chẩn đoán sớm HCC (Hinh 4).
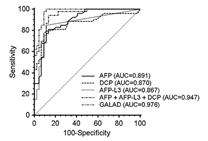
Hình 4. Độ chính xác của (diện tích dưới đường cong: AUC) của AFP, AFP-L3, DCP, của sự kết hợp 3 dấu ấn khối u này và GALAD trong chẩn đoán sớm HCC (Caviglia et al, 2016 [2]).Ở Việt Nam, khi nghiên cứu trên 77 bệnh nhân HCC, Don LV và Tùng NĐ (Bệnh viện Quân đội 108, 2016) [5] cho thấy có sự tăng mức độ DCP rõ rệt ở bệnh nhân HCC phụ thuộc vào kích thước khối u (Bảng 8).
Bảng 8. Mức độ DCP ở các kích thước khối u khác nhau (Don LV và Tùng NĐ, 2016 [5]).
Kích thước khối u (cm)
n
Mức độ DCP (mAU/mL)
Trung vị
SD
Khoảng dao động
1-3
25
62,28
78,40
17,77 – 287,54
3-6
14
3895,98
6468,69
47,93 – 20603
6-9
10
12310,48
12277,46
80,43 – > 30000,0
≥ 9
15
21232,17
12530,38
923,01 – > 30000,0
Theo Don LV và Tùng NĐ, 2016 [5], nếu lấy giá trị cắt của DCP là 30 mAU/mL, DCP có độ nhạy chẩn đoán HCC là 77,9% và độ đặc hiệu là 90,8%; nếu kết hợp AFP và DCP thì độ nhạy chẩn đoán HCC là 82,9% và độ đặc hiệu là 88,4%.2.2. Vai trò của AFP, AFP-L3 và DCP trong chẩn đoán phân biệt giữa HCC và viêm gan. Durazo FA, 2008 [6] trong một nghiên cứu trên 240 bệnh nhân viêm gan B và viêm gan C mạn, trong đó có 47 viêm gan mạn (xơ hóa gan giai đoạn I-III) và 49 xơ gan (được đánh giá bằng sinh thiết gan) và 144 bị ung thư biểu mô tế bào gan (HCC), đã thấy rằng: Đường cong ROC chỉ ra rằng giá trị cắt (cut-off) với độ nhạy tốt nhất và đặc trưng đối với DCP là ≥ 84 AU/ L, đối với AFP là ≥ 25 ng/ mL và đối với AFP-L3 là ≥ 10%. Độ nhạy chẩn đoán, độ đặc hiệu và giá trị dự đoán (+) tính (PPV) đối với HCC của DCP tương ứng là 87%, 85% và 86,8%, của AFP tương ứng là 69%, 87% và 69,8%, và của AFP-L3 tương ứng là 56%, 90% và 56,1%. Những bệnh nhân bị HCC có mức độ DCP, AFP và AFP L-3 huyết thanh cao hơn một cách rất rõ rệt so với những bệnh nhân viêm gan, xơ hóa gan và xơ gan không bị HCC (P ≤ 0,0001). Trong một nghiên cứu khác (Caviglia GP, 2016 [2], khi nghiên cứu trên 99 bệnh nhân, trong đó có 44 bệnh nhân viêm gan mạn, xơ hóa gan hoặc xơ gan và 54 bệnh nhân HCC, cũng thấy có sự khác nhau một cách có ý nghĩa rất rõ rệt (P <0,0001) giữa mức độ AFP, AFP-L3 và DCP ở các bệnh nhân HCC và không HCC. Ở Việt Nam, khi nghiên cứu trên 77 bệnh nhân HCC và 40 bệnh nhân viêm gan mạn và xơ gan, Don LV và Tùng NĐ (Bệnh viện Quân đội 108, 2016) [5] cho thấy có sự tăng mức độ DCP rõ rệt ở bệnh nhân HCC với ở bệnh nhân viêm gan mạn hoặc xơ gan (Bảng 9).
Bảng 9. So sánh mức độ DCP ở bệnh nhân HCC và bệnh nhân viêm gạn mạn hoặc xơ gan ở Việt Nam (Don LV và Tùng NĐ, 2016 [5]).
Dấu ấn khối u
HCC
(n = 77)
Viêm gan mạn hoặc xơ gan
(n = 40)
P
DCP (mAU/mL)
6804,1 ± 11102,3
22,5 ± 4,1
< 0,001
Khoảng dao động
10,5 – 30000
16,5 – 32,6
Don LV và Tùng NĐ (2016) [5] cũng thấy có sự khác nhau về mức độ DCP tăng phụ thuộc vào mức độ biệt hóa của tế bào trong HCC: mức độ biệt hóa tế bào càng thấp thì mức độ DCP càng cao (Bảng 10).
Bảng 10. Mức độ DCP ở các mức độ biệt hóa tế bào khác nhau (Don LV và Tùng NĐ, 2016 [5]).
Mức độ biệt hóa tế bào
n
Mức độ DCP (mAU/mL)
Cao
14
7632,8 ± 1253,4
Trung bình
17
16677,7 ± 2905,1
Thấp
3
>30000,0
2.3. Vai trò của AFP, AFP-L3 và DCP trong đánh giá đáp ứng điều trị HCC
Trong điều trị HCC bằng phẫu thuật cắt bỏ khối u,nghiên cứu trên 96 bênh nhân HCC trước phẫu thuật và 77 bệnh nhân HCC 1 tháng sau phẫu thuật, Yamamoto K, 2010 [14] thấy rằng giá trị của các dấu ấn AFP, AFP-L3 và DCP đều giảm một cách có ý nghĩa rất rõ rệt (Bảng 11).
Bảng 11. Giá trị của các dấu ấn khối u AFP, AFP-L3 và DCP trong đánh giá đáp ứng điều trị bằng phẫu thuật gan (Yamamoto K, et al, 2010 [14]).
Trước phẫu thuật (n=96)
Sau phẫu thuật 1 tháng (n=77)
P
AFP (ng/mL)
8,0 (4,0-142,8)
5,9 (3,0-8,5)
< 0,001
AFP-L3 (%)
0,0 (0,0-3,9)
0,0 (0,0-0,0)
< 0,001
DCP (AU/L)
67,5 (20,0-350,3)
17,0 (14,0-26,0)
< 0,0001
2.4. Vai trò của AFP, AFP-L3 và DCP trong theo dõi tái phát HCC sau điều trị Nghiên cứu trên 714 bệnh nhân HCC được phẫu thuật cắt bỏ khối u, Yamamoto K, 2009 [13] thấy rằng, trạng thái AFP và DCP với giá trị cắt 20 ng/mL và 40 IU/L, trở nên (-) tính ở thời điểm 6 tháng sau điều trị tương ứng là 184/ 229 (80,3%) và 245/246 (99,6%) (P<0,0001). Theo Chon YE, 2012 [4], độ nhạy và độ đặc hiệu để phát hiện tái phát sau phẫu thuật cắt khối u HCC được cải thiện khi kết hợp AFP và DCP tương ứng là 66,7% và 47,9%, trong khi của AFP tương ứng là 60,1% và 45,2%, còn của DCP tương ứng là 62,9% và 47,9%. Theo Yamamoto K, 2010 [14], với các giá trị cắt của AFP là 200 ng/mL, AFP-L3 là 10% và DCP là 60 AU/L, có sự thay đổi trạng thái (+)/(-) của AFP, AFP-L3 và DCP sau phẫu thuật HCC và có sự liên quan đến nguy cơ tái phát sớm (Bảng 12).
Bảng 12. Sự thay đổi trạng thái (+)/(-) của AFP, AFP-L3 và DCP sau phẫu thuật HCC và sự liên quan đến nguy cơ tái phát sớm (Yamamoto K, 2010 [14]).
Trước phẫu thuật
Sau phẫu thuật
Trạng thái dấu ấn khối u
Số bệnh nhân (%)
Trạng thái dấu ấn khối u
Số bệnh nhân (%)
Số bệnh nhân bị tái phát ≤ 6 tháng (%)
Tỷ lệ nguy cơ (95% CI)
Giá trị cắt AFP ở 200 ng/mL
AFP (-)
AFP (+)
75/96 (78,1%)
21/96 (%)
AFP (-)
AFP (+)
AFP (-)
AFP (+)
75/75 (100%)
0/75 (0,0%)
15/21 (71,4%)
6/21 (28,6%)
11/75 (14,7%)
0/0 (0,0%)
4/15 (26,7%)
4/6 (66,7%)
2,50 (0,91-6,88)
Giá trị cắt AFP-L3 ở 10%
AFP-L3 (-)
AFP-L3 (+)
75/96 (78,1%)
21/96 (21,9%)
AFP-L3 (-)
AFP-L3 (+)
AFP-L3 (-)
AFP-L3 (+)
74/75 (98,7%)
1/75 (1,3%)
15/21 (71,4%)
6/21 (28,6%)
13/74 (17,6%)
0/1 (0,0%)
2/15 (13,3%)
4/6 (66,7%)
5,00 (1,22-20,46)
Giá trị cắt DCP ở 60 AU/L
DCP (-)
DCP (+)
46/96 (47,9%)
50/96 (52,1%)
DCP (-)
DCP (+)
DCP (-)
DCP (+)
44/46 (95,7%)
2/46 (4,3%
46/50 (95,7%)
4/50 (8,0%)
5/44 (11,4%)
1/2 (50,0%)
11/46 (23,9%)
2/4 (50,0%)
2,09 (0,40-25,32)
Giá trị cắt kết hợp
Sự kết hợp (-)
Sự kết hợp (+)
71/96 (74%)
25/96 (26,0%)
Sự kết hợp (-)
Sự kết hợp (+)
Sự kết hợp (-)
Sự kết hợp (+)
70/71 (98,6%)
1/71 (1,4%)
17/25 (68,0%)
8/25 (32,0%)
11/70 (15,7%)
0/1 (0,0%)
3/17 (17,7%)
5/8 (62,5%)
3,54 (1,11-11,29)
CI = confidence interval (khoảng tin cậy).
2.5. Vai trò của AFP, AFP-L3, DCP và số điểm BALAD trong đánh giá tiên lượng HCCTrong điều trị HCC bằng phẫu thuật cắt bỏ khối u, Nanashima A, 2011 [10] thấy rằng những bệnh nhân có mức độ AFP và DCP tăng cao hơn sau phẫu thuật thường có khả năng sống sót kém hơn đáng kể so với những bệnh nhân có mức độ các dấu ấn bình thường. Mức độ tăng nhanh của các dấu ấn thể hiện khả năng xâm lấn của khối u còn sót lại sau phẫu thuật. Thời gian để mức độ các dấu ấn tăng gấp đôi càng nhanh thì thời gian sống sót càng ngắn (Park H, 2013 [11]).Trong điều trị HCC bằng nút hóa chất động mạch gan (transarterial chemoembolization: TACE), người ta thấy có sự khác biệt đáng kể về thời gian sống trung bình giữa những người đáp ứng và không đáp ứng về dấu ấn khối u AFP 3 đến 6 tháng sau điều trị (Park WH, 2012 [12]). Mức độ AFP trước điều trị là yếu tố dự đoán độc lập đối với thời gian sống sót, còn mức độ DCP trước điều trị thì không. Những bệnh nhân có đáp ứng với AFP và/ hoặc đáp ứng với DCP có thời gian sống dài hơn rõ rệt so với những người không đáp ứng đối với hai dấu ấn khối u này (39,0 so với 21,5 tháng).Trong điều trị HCC bằng truyền hóa chất định kỳ qua động mạch gan (hepatic artery infusional chemotherapy: HAIC): những bệnh nhân đáp ứng với AFP có thời gian sống tốt hơn đáng kể so với những người không đáp ứng với AFP (17,3 so với 6,4 tháng), trong khi thời gian sống ở bệnh nhân đáp ứng với DCP không khác biệt so với ở bệnh nhân không đáp ứng với DCP (Lee MH, 2012 [9]).Trong điều trị bằng hóa xạ trị đồng thời (concurrent chemoradiation therapy: CCRT): những bệnh nhân đáp ứng với AFP có thời gian sống sót dài hơn một cách có ý nghĩa so với những bệnh nhân không đáp ứng (17,6 so với 8,7 tháng), nhưng những bệnh nhân đáp ứng và không đáp ứng với DCP không có sự khác nhau về thời gian sống sót.Trong điều trị đích bằng sorafenib ở bệnh nhân HCC, sau 4 tuần điều trị, Kuzuya T, 2011 [8]: Ở nhóm bệnh nhân có mức độ AFP cao, những bệnh nhân sau điều trị có mức AFP thấp hơn có thời gian sống trung bình dài hơn một cách có ý nghĩa so với nhóm có mức AFP cao hơn (3,5 so với 2,1 tháng). Ở nhóm bệnh nhân có mức độ AFP thấp, thời gian sống sót có xu hướng dài hơn ở bệnh nhân có mức độ AFP thấp hơn nhưng không có ý nghĩa thống kê (9,3 so với 5,1 tháng). Không có sự khác biệt đáng kể về thời gian sống sót ở cả hai nhóm có mức độ DCP thấp và cao. Bệnh nhân có mức độ DCP > 1.000 AU/ L và có sự tăng sớm của mức AFP sau điều trị có thời gian sống sót ngắn hơn.Khi sử dụng số điểm BALAD-2 để đánh giá thời gian sống sót (tính theo tháng) của bệnh nhân HCC, các nghiên cứu ở Anh Quốc, Nhật và Đức cho thấy số điểm BALAD-2 càng cao thì thời gian sống sót của bệnh nhân càng ngắn (Berhane S, et al, 2016 [1]) (Bảng 13).Bảng 13. Thời gian sống sót (tháng) của bệnh nhân HCC tính theo số điểm BALAD-2 (Berhane S, et al, 2016 [1]).
Nước nghiên cứu
Số điểm BALAD-2
n
Thời gian sống sót, tháng (95% CI)
Anh Quốc
1
2
3
4
111
116
91
56
26,1 (18,6-35,8)
17,6 (12,4-19,2)
7,0 (5,6-9,5)
2,0 (1,3-2,8)
Nhật
1
2
3
4
816
379
208
111
78,9 (71,6-86,3)
30,0-(26,9-34,4)
11,7 (9,6-15,6)
2,0 (1,6-3,1)
Đức
1
2
3
4
90
54
67
40
28,1 (18,7-38,8)
14,1 (7,6-20,9)
6,7 (5,3-8,1)
2,4 (1,3-3,8)
Hồng Kông
1
2
3
4
68
67
61
50
– (34,8-)
15,0 (11,3-25,8)
4,3 (3,1-5,3)
1,6 (1,1-2,6)
Kết luận
1. Sự kết hợp AFP, AFP-L3 và DCP có vai trò trong phát hiện sớm HCC (giai đoạn I, kích thước khối u <2 cm, và chỉ có 1 khối u), nếu kết hợp thêm với giới (Gender) và tuổi (Age) trong mô hình GALAD, việc phát hiện HCC sớm sẽ hiệu quả hơn.
2. Các dấu ấn AFP, AFP-L3 và DCP có giá trị trong chẩn đoán phân biệt HCC với viêm gan mạn, xơ hóa gan tiến triển hoặc xơ gan, ở đây, việc kết hợp với chẩn đoán hình ảnh là cần thiết.
3. Các dấu ấn AFP, AFP-L3 và DCP cũng có giá trị trong đánh giá hiệu quả điều trị HCC bằng phẫu thuật.
4. Các dấu ấn AFP, AFP-L3 và DCP còn có giá trị trong theo dõi tái phát sau điều trị HCC bằng phẫu thuật.
5. Sự kết hợp AFP, AFP-L3 và DCP, và nếu kết hợp thêm Bilirrubin và Albumin trong mô hình BALAD-2, giá trị tiên lượng thời gian sống sót của bệnh nhân HCC của sự kết hợp này sẽ chính xác hơn của AFP hoặc DCP một mình.
Tài liệu tham khảo
1. Berhane S, Toyoda H, Tada T, et al. Role of the GALAD and BALAD-2 Serologic Models in Diagnosid of Hepatocellular Carcinoma and Prediction of Survival in Patients. Clin Gastroenterol Hepatol 2016; 14(6): 875-886. 2. Caviglia GP, Abate ML, Petrini E, et ak. Highly sesitive alpha-fetoprotein, Lens culinaris agglutinin reactive fraction of alpha-fetoprotein and des-gammacarboxyprothrombin for hepatocellular carcinoma detection. Hepatology Research 2016; 14: 875-886. 3. Choi JY, Jung SW, Kim HY, Kim M, Kim Y, Kim DG and Oh E. Diagnostic value of AFP-L3 and PIVKA-II in hepatocellular carcinoma according to total-AFP. World J Gastroenterol 2013 Jan 21; 19(3): 339-346. World J Gastroenterol 2013 Jan 21; 19(3): 339-346. 4. Chon YE, Choi GH, Lee MH, et al. Combined measurement of preoperative α-fetoprotein and des-γ-carboxy prothrombin predicts recurrence after curative resection in patients with hepatitis-B-related hepatocellular carcinoma. International Journal of Cancer 2012; 131(10): 2332-2341. 5. Lê Văn Don và Nguyễn Đăng Tùng. Nghiên cứu giá trị xét nghiệm PIVKA-II, panel PIVKA-II kết hợp với AFP trong chẩn đoán ung thư tế bào gan.Tạp chí Y Dược Lâm sàng 108, 2016; 11: 22-27. 6. Durazo FA, Blatt LM, Corey WG, Tong MJ. Des-γ-carboxyprothrombin, α-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J Gastroenterol Hepatol 2008; 23(10): 1541-1548. 7. Mai Trọng Khoa, Trần Đình Hà, Phạm Cẩm Phương, và cs. Bước đầu định lượng ba chỉ số AFP, AFP-L3 và PIVKA-II ở người khỏe mạnh và mootjsoos bệnh nhân u gan tại Bệnh viện Bạch Mai. Tạp chí Y Dược Lâm sàng 108, 2016; 11: 16-21. 8. Kuzuya T, Asahina Y, Tsuchiya K, et al. Early decrease in α-fetoprotein, but not des-γ-carboxy prothrombin, predicts sorafenib efficacy in patients with advanced hepatocellular carcinoma. Oncology 2011; 81(3-4): 251-258. 9. Lee MH, Kim SU, Kim DY, et al. Early on-treatment predictions of clinical outcomes using alpha-fetoprotein and des-gamma-carboxy prothrombin responses in patients with advanced hepatocellular carcinoma. J Gastroenterol Hepatol 2012; 27(2): 313-322. 10. Nanashima A, Taura N, Abo T, et al. Tumor marker levels before and after curative treatment of hepatocellular carcinoma as predictors of patient survival. Digestive Diseases and Sciences 2011; 56(10): 3086-3100. 11. Park H and Park JY. Clinical Significance of AFP and PIVKA-II Responses for Monitoring Treatment Outcomes and Predicting Prognosis in Patients with Hepatocellular Carcinoma. BioMed Research International 2013; Volume 2013: 6 pages. 12. Park WH, Shim JH, Han SB, et al. Clinical utility of des-gamma-carboxyprothrombin kinetics as a complement to radiologic response in patients with hepatocellular carcinoma undergoing transarterial chemoembolization. J Vasc Interv Radiol 2012; 23(7): 927-936. 13. Yamamoto K, Imamura H, Matsuyama Y, Hasegawa K, Beck Y, Sugawara Y, Makuuchi M, Kokudo N. Significance of alpha-fetoprotein and des-gamma-carboxy prothrombin in patients with hepatocellular carcinoma undergoing hepatectomy. Ann Surg Oncol 2009 Oct; 16(10): 2795-2804. 14. Yamamoto K, Imamura H, Matsuyama Y, et al. AFP, AFP-L3, DCP, and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC. J Gastroenterol 2010 Dec; 45(12): 1272-1282.
