Các globulin miễn dịch (Ig) là các kháng thể, có bản chất là glycoprotein, do các tế bào lympho B cũng như các tương bào tổng hợp khi cơ thể bị phơi nhiễm với các kháng nguyên, có vai trò giúp hệ thống miễn dịch nhận biết và vô hiệu hóa các tác nhân lạ, chẳng hạn các vi khuẩn hoặc virus.
24/12/2018 | Liệu pháp miễn dịch: Bước đột phá trong điều trị ung thư năm 201813/07/2018 | Giá trị của xét nghiệm thấm miễn dịch để phát hiện kháng thể IgE đặc hiệu dị nguyên đối với 96 dị nguyên ở bệnh nhân bị dị ứng22/11/2017 | 10 thực phẩm quan trọng giàu chất dinh dưỡng tốt cho hệ miễn dịch
1. Cấu trúc phân tử của globulin miễn dịch
Phân tử kháng thể được tạo thành từ 4 chuỗi polypeptide, gồm hai chuỗi nặng (H: heavy) giống nhau và hai chuỗi nhẹ (L: light) cũng giống nhau. Phân tử Ig gồm hai chuỗi nhẹ là chuỗi nhẹ κ (kappa) và chuỗi nhẹ λ (lambda), do đó hai chuỗi nhẹ của mỗi phân tử Ig chỉ có thể cùng là κ hoặc cùng là λ. Các chuỗi của Ig liên kết với nhau bởi các cầu nối disulfide (-S-S-), tạo nên hình chữ “Y” (Williams AF, 1988 [6]). Một phần cấu trúc của các chuỗi là vùng (domain) hằng định C (constant), còn phần đầu của hai “cánh tay” chữ Y là vùng rất biến đổi V (variable) giữa các kháng thể khác nhau, tạo nên các vị trí kết hợp có khả năng gắn đặc hiệu với các kháng nguyên tương ứng, điều này cũng tương tự như sự gắn của một enzyme với cơ chất đặc hiệu của nó (Schroeder HW, 2010 [4]).
1.1. Các vùng hằng định C
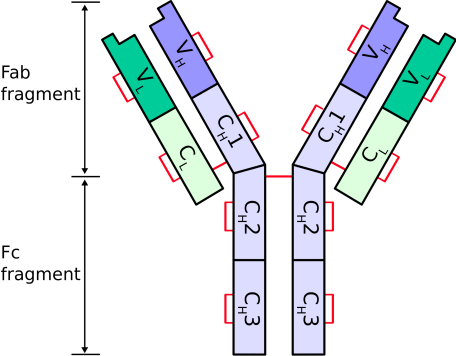 Hình 1: Sơ đồ các chuỗi của một kháng thể
Hình 1: Sơ đồ các chuỗi của một kháng thể
Các vùng hằng định C được đặc trưng bởi các chuỗi acid amin khá giống nhau giữa các kháng thể. Vùng hằng định của chuỗi nhẹ ký hiệu là CL. Các chuỗi nặng ký hiệu là H chứa 3 hoặc 4 vùng hằng định, tùy theo lớp kháng thể CH1, CH2, CH3 và CH4.
Các vùng hằng định C không có vai trò nhận diện kháng nguyên, chúng chỉ có vai trò làm cầu nối giữa các phân tử kháng thể với các tế bào miễn dịch cũng như với bổ thể. Phần chân của chữ Y được gọi là đoạn Fc (F: fragment, c: cristallisable).
1.2. Các vùng biến đổi V Các vùng biến đổi là các vùng khác nhau về thành phần acid amin giữa các loại kháng thể. Mỗi immunoglobulin có 4 vùng biến đổi ở đầu tận hai cánh tay của chữ Y. Sự kết hợp giữa 1 vùng biến đổi trên chuỗi nặng (VH) và 1 vùng biến đổi trên chuỗi nhẹ (VL) tạo nên vị trí nhận diện kháng nguyên. Như vậy, mỗi Ig có hai vị trí gắn kháng nguyên. Hai vị trí này là giống nhau, qua đó một phân tử kháng thể có khả năng gắn với 2 kháng nguyên giống nhau. Hai cánh tay của chữ Y còn gọi là đoạn gắn kháng nguyên Fab (F: fragment, ab: antigen binding), là phần nhận biết kháng nguyên (Nimmerjahn F, 2007 [2]. Vùng kháng nguyên có khả năng gắn vào kháng thể được gọi là epitope.
Các domain sở dĩ gọi là biến đổi vì chúng khác nhau rất nhiều giữa các kháng thể. Sự khác nhau về thành phần acid amin ở vùng biến đổi giữa các loại kháng thể giúp cho các kháng thể nhận biết được nhiều loại tác nhân (kháng nguyên) gây bệnh khác nhau.
2. Tính đặc hiệu của phản ứng kháng nguyên-kháng thể
Tính đặc hiệu của phản ứng kháng nguyên-kháng thể là sự nhận biết giữa các protein kháng nguyên của bản thân (self) với các protein kháng nguyên “lạ”, không phải của bản thân (non-self). Khi bị phơi nhiễm với một protein kháng nguyên “lạ”, kháng nguyên này sẽ kích thích hệ thống miễn dịch của cơ thể chống lại bằng các đáp ứng miễn dịch tế bào và đáp ứng miễn dịch dịch thể, giúp cơ thể chống lại bệnh tật. Điều đáng chú ý là một kháng nguyên không gây bệnh, nhưng là “lạ”, cũng có khả năng kích thích cơ thể sinh kháng thể.
Các kháng thể được sinh ra để chống lại chính các protein kháng nguyên của cơ thể mình gọi là các tự kháng thể (autoimmunoglobulins). Bình thường, các tự kháng thể được sinh ra một cách tự phát, với số lượng ít và thường đặc hiệu với nhiều kháng nguyên của cơ thể nên được gọi là các kháng thể đa đặc hiệu. Các kháng thể này thường không gây nên phản ứng đáng kể. Tuy nhiên, khi cơ chế điều hòa miễn dịch bị rối loạn, chẳng hạn trong các bệnh tự miến (như bệnh gan tự miễn, Lupus ban đỏ hệ thống, Hội chứng Anti-phospholipid, …), số lượng các kháng thể tự miễn được tổng hợp rất nhiều, phản ứng giữa kháng nguyên của cơ thể với các tự kháng thể sinh ra xảy ra rất mạnh mẽ, tình trạng bệnh lý xuất hiện.
Trong quá trình phát triển và biệt hóa các tế bào lympho B, có sự tái tổ hợp các gene mã hóa các Ig.
Trong mỗi tế bào lympho B, tổ hợp gene của phần biến thiên chỉ xảy ra 1 lần sẽ giữ nguyên đến hết đời sống của tế bào đó. Nếu vượt qua được các cơ chế chọn lọc, lympho B sẽ tiếp tục sống:
- Lympho B sẽ tồn tại ở dạng“trinh nữ” (naïve) cho đến khi gặp kháng nguyên tương ứng.
- Nếu không gặp kháng nguyên, lympho B hoạt động cầm chừng dưới dạng naive đến hết đời của nó.
- Khi gặp kháng nguyên đặc hiệu, với sự trợ giúp của các lympho Th1, qua các cytokins, các lympho B sẽ phân chia thành các dòng, một số sẽ biệt hóa thành các tương bào có khả năng tổng hợp hàng loạt các kháng thể, một số lympho B khác sẽ trở thành các tế bào lympho B nhớ và tiếp tục phân bào, duy trì sự tồn tại của dòng tế bào đó trong cơ thể. Nếu bị phơi nhiễm với kháng nguyên đó một lần nữa, các tế bào B nhớ sẽ đáp ứng nhanh hơn dạng naïve. Ưu điểm này của đáp ứng miễn dịch đặc hiệu là nguyên tắc của việc tiêm phòng ngừa bệnh bằng vaccin.
Trong số các Ig cơ thể có khả năng tổng hợp, có những phân tử Ig rất giống nhau. Khi một kháng nguyên phơi nhiễm với hệ thống miễn dịch, các dòng kháng thể tương tự đều được kích thích với những mức độ khác nhau, trong đó dòng kháng thể đặc hiệu chính đáp ứng mạnh mẽ nhất.
3. Ái lực giữa kháng nguyên và kháng thể
Liên kết giữa kháng nguyên và kháng thể cũng tương tự như liên kết giữa enzyme và cơ chất, nghĩa là có khả năng thuận nghịch. Sự liên kết giữa kháng nguyên và kháng thể mạnh hay yếu tùy vào số lượng liên kết và độ đặc hiệu giữa vùng nhận diện kháng nguyên trên kháng thể và cấu trúc vùng epitope trên kháng nguyên tương ứng.
Ái lực của kháng nguyên đối với kháng thể là sự tổng hợp của các lực liên kết yếu không đồng hóa trị (như các liên kết hydro, lực van der Waals, liên kết ion, liên kết không phân cực). Các lực liên kết yếu này chỉ có tác dụng trong một phạm vi nhỏ, do đó sự đặc hiệu trong cấu trúc không gian 3 chiều của 2 vùng phân tử có vai trò quyết định đối với ái lực của kháng nguyên với kháng thể.
Một kháng nguyên có thể được nhận diện bởi nhiều kháng thể với độ đặc hiệu khác nhau, dòng kháng thể nào phù hợp nhất về cấu trúc 3 chiều với epitope của kháng nguyên sẽ được thể hiện mạnh nhất.
4. Chức năng của các kháng thể
Trong một đáp ứng miễn dịch, kháng thể có 3 chức năng chính là liên kết với kháng nguyên, kích hoạt hệ thống bổ thể và huy động các tế bào miễn dịch.
4.1. Liên kết với kháng nguyên Các globulin miễn dịch có khả năng nhận diện và gắn một cách đặc hiệu với 1 kháng nguyên tương ứng nhờ các vùng biến đổi. Ví dụ, trong phản ứng chống độc tố vi khuẩn, kháng thể gắn và qua đó trung hòa độc tố, ngăn ngừa sự bám dính của các độc tố này lên các thụ thể trên bề mặt của tế bào, vì vậy, các tế bào của cơ thể tránh được các rối loạn do các độc tố đó gây ra.
Nhiều virus và vi khuẩn chỉ gây bệnh khi bám được vào các tế bào cơ thể. Vi khuẩn sử dụng các phân tử bám dính là các adhesine, còn virus sử dụng các protein cố định trên lớp vỏ ngoài để bám vào các tế bào của cơ thể. Các kháng thể kháng các phân tử bám dính adhesine của vi khuẩn và các kháng thể kháng proteine capside của virus sẽ ngăn chặn các vi sinh vật này gắn vào các tế bào đích của chúng.
4.2. Hoạt hóa bổ thể Một trong những cơ chế bảo vệ cơ thể của kháng thể là sự hoạt hóa dòng thác bổ thể. Bổ thể là một tập hợp các protein huyết tương khi được hoạt hóa sẽ có tác dụng tiêu diệt các vi khuẩn xâm nhập bằng các cách:
– Đục các lỗ thủng trên vi khuẩn. – Tạo điều kiện cho hiện tượng thực bào. – Thanh thải các phức hợp miễn dịch. – Phóng thích các phân tử hóa hướng động.
4.3. Huy động các tế bào miễn dịch Sau khi gắn vào kháng nguyên ở đầu biến đổi (Fab), kháng thể có thể liên kết với các tế bào miễn dịch ở đầu hằng định (Fc). Những tương tác này có tầm quan trọng đặc biệt trong đáp ứng miễn dịch. Bằng cách này, các kháng thể có khả năng gắn với một vi khuẩn với một đại thực bào và kích hoạt hiện tượng thực bào. Các tế bào lympho giết tự nhiên (natural killer) có thể thực hiện chức năng độc tế bào và ly giải các vi khuẩn (Hashimoto G, 1983 [1]) hoặc tế bào ung thư đã bị gắn kết (opsonine hóa) bởi các kháng thể (Hình 3).
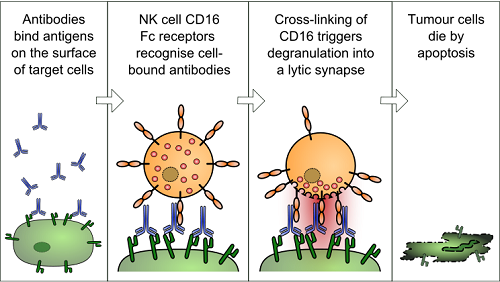 Hình 2. Cơ chế gây độc tế bào phụ thuộc vào phản ứng kháng nguyên – kháng thể. (Antibody-dependent cell-mediated cytotoxicity)
Hình 2. Cơ chế gây độc tế bào phụ thuộc vào phản ứng kháng nguyên – kháng thể. (Antibody-dependent cell-mediated cytotoxicity)
Hệ thống miễn dich ở người có khả năng sản xuất ra trên 1012 loại kháng thể đặc hiệu khác nhau. Những kết quả nghiên cứu mới nhất cho thấy bộ gen (genome) của người chỉ có khoảng 3×105 gene, như vậy một kháng thể không thể chỉ là sản phẩm của một gene duy nhất.
Các tác nhân gây bệnh là rất đa dạng nên số lượng các kháng nguyên mà cơ thể có thể phơi nhiễm là rất lớn. Mỗi lympho B chỉ có khả năng tổng hợp 1 loại kháng thể đặc hiệu đối với 1 epitope kháng nguyên nhất định, do đó cần phải có nhiều triệu lympho B khác nhau. Số lượng này vượt quá số lượng gene của con người. Vì vậy khái niệm trước kia về một gene tổng hợp một kháng thể không còn phù hợp nữa. Tonegawa S (1976) phát hiện ra rằng cơ thể đã sử dụng cơ chế tái tổ hợp gene để tổng hợp ra số kháng thể vô cùng phong phú. Ông đã được giải Nobel Y học năm 1987 về phát hiện này.
Có nhiều gene mã hóa cho phần biến đổi (V) của Ig, các gen này có khả năng tái tổ hợp với nhau một cách ngẫu nhiên để tạo ra số sản phẩm lớn hơn nhiều so với số gen vốn có (Tonegawa S, 1983 [5]). Trong mỗi tế bào lympho B, chỉ một tổ hợp duy nhất của mỗi chuỗi (nặng và nhẹ) được tạo thành và không thay đổi suốt cuộc đời nó.
5. Sự tổng hợp các globulin miễn dịch
Hệ thống miễn dich ở người có khả năng sản xuất ra trên 1012 loại kháng thể đặc hiệu khác nhau. Những kết quả nghiên cứu mới nhất cho thấy bộ gen (genome) của người chỉ có khoảng 3×105 gene, như vậy một kháng thể không thể chỉ là sản phẩm của một gene duy nhất.
Các tác nhân gây bệnh là rất đa dạng nên số lượng các kháng nguyên mà cơ thể có thể phơi nhiễm là rất lớn. Mỗi lympho B chỉ có khả năng tổng hợp 1 loại kháng thể đặc hiệu đối với 1 epitope kháng nguyên nhất định, do đó cần phải có nhiều triệu lympho B khác nhau. Số lượng này vượt quá số lượng gene của con người. Vì vậy khái niệm trước kia về một gene tổng hợp một kháng thể không còn phù hợp nữa. Tonegawa S (1976) phát hiện ra rằng cơ thể đã sử dụng cơ chế tái tổ hợp gene để tổng hợp ra số kháng thể vô cùng phong phú. Ông đã được giải Nobel Y học năm 1987 về phát hiện này.
Có nhiều gene mã hóa cho phần biến đổi (V) của Ig, các gen này có khả năng tái tổ hợp với nhau một cách ngẫu nhiên để tạo ra số sản phẩm lớn hơn nhiều so với số gen vốn có (Tonegawa S, 1983 [5]). Trong mỗi tế bào lympho B, chỉ một tổ hợp duy nhất của mỗi chuỗi (nặng và nhẹ) được tạo thành và không thay đổi suốt cuộc đời nó.
5.1. Sự tổ chức, tái tổ hợp và giải mã các gene chuỗi nặng Phần hằng định (C) của chuỗi nặng được mã hóa bởi 1 trong số 9 gen tùy theo từng lớp (isotype) kháng thể: µ mã hóa cho IgM; γ1 – 4 cho IgG1 – IgG4; α1 và α2 cho IgA1 và IgA2; δ cho IgD và ε cho IgE.
Các gen mã hóa chuỗi nặng của immunoglobulin nằm trên nhiễm sắc thể 14. Ở những tế bào mầm, các gen này được sắp xếp thành 4 vùng tách biệt: các amino acid (aa) 1 – 95 của phần biến đổi (V) được mã hóa bởi khoảng 51 gene V; các aa 96 – 101 do khoảng 27 gene D mã hóa (D: diversity – “phong phú”); các aa 102 – 110 được mã hóa bởi 6 gene J(J: junction).
Mỗi gene V đều có một chuỗi L (leader – dẫn lối). Trong quá trình trưởng thành của tế bào lympho B, một gene D sẽ liên kết với một gene J bằng cách cắt bỏ đoạn DNA trung gian giữa chúng. Đoạn DJ mới được tạo thành cùng với gene Cμ (hằng định) được sao chép thành mRNA tương ứng, dịch mã ra một protein DJ-Cμ tạm thời.
Sau đó, một gene V cùng với đoạn L tương ứng của nó được gắn vào đoạn DJ kể trên (tái tổ hợp VDJ). Gene VDJ mới tổ hợp và gene Cμ được dịch mã tạo ra protein VDJ-Cμ. Chuỗi L sau đó được cắt ra, tạo thành protein chuỗi nặng của kháng thể IgM.
Như vậy, sự tái tổ hợp các gene trên NST 14 có khả năng tạo ra 8.262 chuỗi nặng khác nhau (51V × 27D × 6J).
5.2. Sự tổ chức, tái tổ hợp và giải mã các gene chuỗi nhẹ kappa Các gene của chuỗi nhẹ κ (kappa) nằm trên nhiễm sắc thể số 2. Tại phần biến thiên (V), các acid amin (aa) 1 – 95 được mã hóa bởi 40 gene VL và các aa từ 96 – 110 được mã hóa bởi 5 gene JL. Chỉ 1 gene Cκ mã hóa cho phần hằng định của chuỗi nhẹ này. Như vậy, sự tái tổ hợp của một gene VLκ với một gene JLκ có thể tạo ra 200 chuỗi nhẹ κ khác nhau (40 × 5).
5.3.Sự tổ chức, tái tổ hợp và giải mã các gene chuỗi nhẹ lambda Các gene của chuỗi nhẹ λ (lambda) thuộc nhiễm sắc thể 22. Tương tự chuỗi nhẹ κ, phần biến thiên (V) của chuỗi nhẹ λ cũng được mã hóa bởi các gene VL và các gene JL. Số lượng các gene chưa được thống kê đầy đủ, ngoài ra còn có nhiều gene Cλ có đoạn gene L đi trước. Sự tái tổ hợp các gene λ có thể tạo ra 116 chuỗi nhẹ λ khác nhau.
5.4.Sự điều hòa tổng hợp các kháng thể Sự tái tổ hợp các gene V, D và J trong các chuỗi nặng và chuỗi nhẹ chịu sự điều hòa của các gene chức năng khác trong nhân tế bào, đặc biệt là các gene hoạt hóa sự tái tổ hợp RAG1 và 2 (recombinatioin activating gene) trên nhiễm sắc thể số 11. Khi các gene này bị rối loạn, sự tổng hợp các kháng thể Ig cũng như các thụ thể kháng nguyên tế bào T (TCR) bị rối loạn trầm trọng, tình trạng này có thể gặp trong bệnh suy giảm miễn dịch bẩm sinh nặng (SCID: severe congenital immunodeficiency disease).
Sự tái tổ hợp gene các chuỗi nặng có thể tạo ra 2,6 × 106 các Ig khác nhau (8262H × (200Lκ + 116Lλ)).
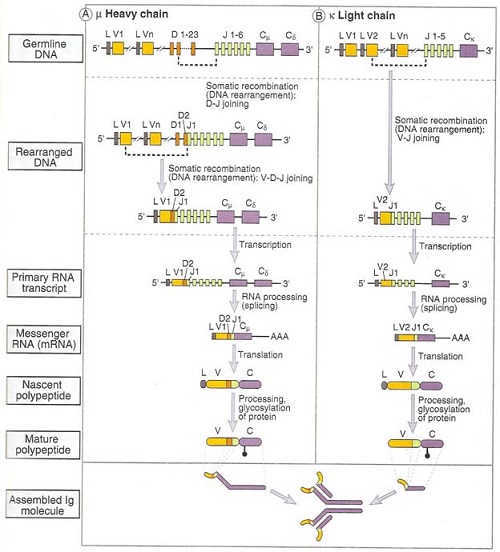 Hình 3. Sự tái tổ hợp gene trong tổng hợp chuỗi nặng và chuỗi nhẹ của kháng thể.
Hình 3. Sự tái tổ hợp gene trong tổng hợp chuỗi nặng và chuỗi nhẹ của kháng thể.
6. Các lớp globulin miễn dịch
Các globulin miễn dịch được chia thành 5 lớp (classes hay isotypes), tùy thuộc vào cấu tạo của các vùng hằng định của các chuỗi nặng: các chuỗi γ, α, μ, ε và δ tương ứng với các Ig thuộc các lớp IgG, IgA, IgM, IgE và IgD.
Ngoài ra, các khác biệt tinh tế hơn cũng tồn tại ở một số lớp immunoglobulin. Ở người, có 4 loại IgG (IgG1, IgG2, IgG3 và IgG4) và 2 loại IgA (IgA1 và IgA2).
Để phá hủy tác nhân gây bệnh đã được gắn với các kháng thể, các tế bào bạch cầu sử dụng các thụ thể của Fc (FcR (Fc receptor) trên bề mặt của chúng, tương ứng với từng lớp IgG, IgA, IgM, IgE và IgD.
Các lớp kháng thể gồm:
6.1. IgG – IgG là loại immunoglobulin monomer, là kháng thể phổ biến nhất trong máu, sữa non và các dịch mô (Woof JM, . – Vai trò chính của IgG là hoạt hóa bổ thể và opsonine hóa. – IgG có 4 dưới lớp: IgG1 (66%), IgG2 (23%), IgG3 (7%) và IgG4 (4%), trong đó IgG4 không có chức năng hoạt hóa bổ thể (Normansell DE, 1987 [3]). – IgG là kháng thể có khả năng đi qua hàng rào máu mẹ – nhau thai nên là kháng thể duy nhất có khả năng truyền từ mẹ sang con trước khi sinh. – IgG loại kháng thể chủ yếu được tổng hợp khi cơ thể bị phơi nhiễm lần thứ hai với kháng nguyên. – IgG đóng vai trò bảo vệ quan trọng bậc nhất trong hệ thống miễn dịch của cơ thể. – IgG có ái lực với kháng nguyên cao hơn và có thời gian lưu thông trong máu tuần hoàn lâu hơn so với IgM. – IgG có khả năng kích hoạt hệ thống bổ thể. – IgG là kháng thể hoạt động tốt nhất trong hệ thống tuần hoàn. -. IgG là kháng thể chủ yếu lưu hành trong hệ thống tuần hoàn, chiếm tới 70% số lượng các kháng thể. – IgG có thời gian bán hủy là khoảng 20 ngày.
6.2. IgM – IgM là kháng thể đầu tiên được tổng hợp khi các tế bào T phát hiện ra kháng nguyên – IgM là lớp kháng thể đầu tiên được tổng hợp sau khi các phản ứng miễn dịch dịch thể được kích hoạt. – Các kháng thể IgA xuất hiện sau khi tiêm chủng. – IgM cũng rất có hiệu quả trong việc ngăn chặn các nhiễm virus. – Là kháng thể đầu tiên một trẻ có khả năng tổng hợp. – IgM có khả năng kích hoạt hệ thống bổ thể. – IgM có khả năng gắn kháng nguyên với nhau một cách mạnh mẽ để chúng có thể bị thực bào bởi các tế bào bạch cầu. – IgM lưu hành trong máu dưới dạng 5 đơn vị (pentamer) hình sao hoặc 6 đơn vị (hexamer). IgM thường được được hình thành với sự tham gia của 5 đơn vị kháng thể cơ bản. – IgM chiếm khoảng 10% trong tổng số các globulin miễn dịch. – IgM là một kháng thể có kích thước phân tử lớn nhất (khối lượng phân tử = 900 kDa). – IgM có thời gian bán hủy (half-life) là 10 ngày.
6.3. IgA – IgA chiếm khoảng 15 – 20% các immunoglobulin trong máu. – IgA không hoạt hóa bổ thể, khả năng opsonise hóa cũng rất yếu. – Có hai dưới lớp IgA là IgA1 (90%) và IgA2 (10%). Khác với IgA1, các chuỗi nặng và nhẹ của IgA2 không nối với nhau bằng các cầu disulfide mà bằng các liên kết không đồng hóa trị. IgA2 có ít trong huyết thanh, nhưng nhiều trong các dịch tiết. – Trong các dịch tiết, IgA có dạng dimer, nối với nhau bằng hai chuỗi phụ: chuối thứ nhất là protein J (join, không phải là các gene J của Ig), có khối lượng phân tử 1,5 kDa, giàu cysteine và khác biệt hoàn toàn với các chuỗi Ig khác. Chuỗi thứ hai là một polypeptide có tên secretory component cùng có khối lượng phân tử 1,5 kDa, do các tế bào biểu mô tiết ra. IgA còn tồn tại dưới dạng trimer và tetramer. – IgA là kháng thể được thấy chủ yếu trong sữa mẹ, nước bọt, nước mắt và các dịch nhầy (Woof JM, 2005 [7]). – IgA là một kháng thể quan trọng mà một trẻ sơ sinh có thể nhận được từ sữa mẹ. – IgA bắt đầu được tổng hợp từ khi sinh nhưng ngay cả khi một năm tuổi, trẻ cũng chỉ có được mức độ IgA bằng 20% mức độ IgA của người trưởng thành. – IgA có thể thoát khỏi dòng máu và đi vào các dịch của cơ thể. – IgA cũng là kháng thể có vai trò bảo vệ đầu tiên cho các bề mặt niêm mạc của các cơ quan như ruột, mũi và phổi. – IgA đôi khi lưu hành trong máu dưới dạng gồm hai hoặc nhiều hơn các chuỗi kháng thể IgA cơ bản. – Khoảng 20% các kháng thể được tổng hợp là loại IgA. – IgA có thời gian bán hủy là 6 ngày.
6.4. IgD – IgD là loại Ig monomer, – IgD có số lượng rất ít, chiếm chưa đến 1% Ig trên màng tế bào lympho B. – Chức năng của IgD chưa được hiểu biết đầy đủ, nó thường thể hiện đồng thời với IgM và được xem như một dấu ấn (marker) của tế bào B trưởng thành nhưng chưa tiếp xúc kháng nguyên. Có lẽ IgD tham gia vào cơ chế biệt hóa của tế bào B thành tương bào và tế bào B ghi nhớ. – IgD là một thụ thể trên bề mặt tế bào lympho. – IgD có thời gian bán hủy là khoảng 2 ngày.
6.5. IgE – IgE là loại Ig monomer có tỷ lệ carbohydrate khá lớn. – IgE có KLPT 190 kDa. – IgE có trên màng bào tương của bạch cầu ái kiềm và tế bào mast ở mô liên kết. – IgE là kháng thể tham gia vào các phản ứng dị ứng của cơ thể, có vai trò trong phản ứng quá mẫn cấp cũng như trong cơ chế miễn dịch chống lại ký sinh trùng. – IgE cũng có trong các dịch tiết, không có khả năng hoạt hóa bổ thể và dễ bị phân hủy bởi nhiệt. – IgE là kháng thể có mức độ trong máu rất thấp, chỉ chiếm 0,001% lượng các kháng thể có trong máu. – Một số nhà khoa học cho rằng IgE có vai trò ngăn chặn các ký sinh trùng. – IgE là một kháng thể có vai trò bảo vệ cơ thể rất quan trọng ở các nước kém phát triển bơi vì đây là nơi các ký sinh trùng sinh sôi rất mạnh trong các điều kiện mất vệ sinh. – IgE có thời gian bán hủy là khoảng 2 ngày.
Cấu trúc phân tử của các lớp và dưới lớp của các globulin miễn dịch được thể hiện ở Hình 4.
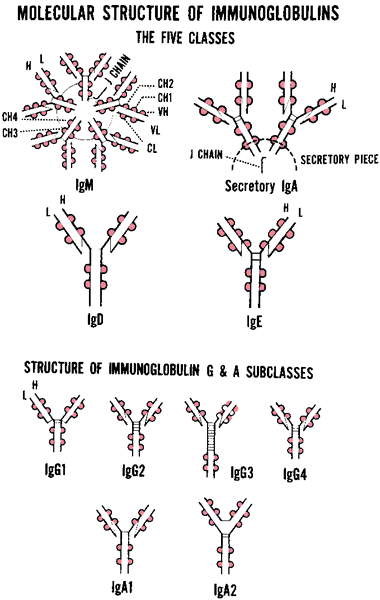 Hình 4. Cấu trúc phân tử của các lớp và dưới lớp của các globulin miễn dịch
Hình 4. Cấu trúc phân tử của các lớp và dưới lớp của các globulin miễn dịch
Đặc điểm về cấu trúc và chức năng của các lớp và dưới lớp của các globulin miễm dịch được thể hiện ở Bảng 1.
Bảng 1. Đặc điểm về cấu trúc và chức năng của các lớp và dưới lớp của các globulin miễm dịch
Các lớp và dưới lớp của Ig
Tỷ lệ trong huyết thanh (%)
Cấu trúc phân tử
Cố định bổ thể
Gắn kết (opsonizing)
Qua nhau thai
Các chức năng khác
Thụ thể Fc (FcR)
IgG
75
Monomer
+
+++
+
Có ở tất cả các dưới lớp của IgG
FcγR
IgG1
67% IgG
Monomer
Có
Có
+
I, II, III
IgG2
22% IgG
Monomer
Có
Có
+
II
IgG3
7% IgG
Monomer
Có
Có
+
I, II, III
IgG4
4% IgG
Monomer
Không
Không
+
I, II
IgM
10
Pentamer
+++
+
–
IgA
15
Monomer, dimer
–
–
–
FcαR (CD89)
IgA1
–
–
–
IgA2
–
–
–
IgD
< 0,5
Monomer
–
–
–
FcδR
IgE
< 0,01
Monomer
–
–
–
FcεR I,II
KẾT LUẬN
- globulin miễn dịch được tạo thành từ 4 chuỗi polypeptide, gồm hai chuỗi nặng (H: heavy) và hai chuỗi nhẹ (L: light) giống hệt nhau.
- Tính đặc hiệu của phản ứng kháng nguyên-kháng thể là sự nhận biết giữa các protein kháng nguyên của bản thân (self) với các protein kháng nguyên “lạ”, không phải của bản thân (non-self).
- Liên kết giữa kháng nguyên và kháng thể cũng tương tự như liên kết giữa enzyme và cơ chất, nghĩa là có khả năng thuận nghịch.
- Trong một đáp ứng miễn dịch, kháng thể có 3 chức năng chính là liên kết với kháng nguyên, kích hoạt hệ thống bổ thể và huy động các tế bào miễn dịch.
- Hệ thống miễn dich ở người có khả năng sản xuất ra trên 1012 loại kháng thể đặc hiệu khác nhau. Sự tổng hợp các Ig được thực hiện bằng cách tái tổ hợp các gen của các chuỗi tương ứng.
- Các globulin miễn dịch được chia thành 5 lớp (classes hay isotypes), tùy thuộc vào cấu tạo của các vùng hằng định của các chuỗi nặng: các chuỗi γ, α, μ, ε và δ tương ứng với các Ig thuộc các lớp IgG, IgA, IgM, IgE và IgD
TÀI LIỆU THAM KHẢO
- Hashimoto G, Wright PF, Karzon DT. Antibody-dependent cell-mediated cytotoxicity against influenza virus-infected cells. The Journal of Infectious Diseases 1983; 148 (5): 785-794.
- Nimmerjahn F, Ravetch JV. FC-receptors are regulators of immunity. Adv Immunol 2007; 96: 179-204.
- Normansell DE. Human immunoglobulin subclasses. Diagn Clin Immunol 1987; 5: 115-128.
- Schroeder HW, and Cavacini L. Structure and Function of Immunoglobulins. J Allergy Clin Immunol 2010 Feb; 125(202): S41-S52.
- Tonegawa S. Somatic generation of antibody diversity. Nature 1983; 302: 575-581.
- Williams AF, Barclay AN. The immunoglobulin superfamily-domains for cell surface recognition. Annu Rev Immunol 1988; 6: 381-405.
- oof JM, and Mestecky J. Mucosal immunoglobulins. Immunol Rev 2005; 206: 64-82.
